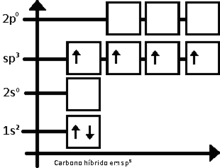
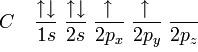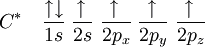El bencno , es un hidrocarburo perteneciente a la familia de los compuestos aromaticos, de tipo poliinsaturado, que sigue la fórmula molecular general C6H6. Su estructura tiene forma de anillo hexagonal característico, conocido como anillo dencenico, o aromático.
La reacción más común en el Benceno es la reacción de sustitucion aromatica, la cual puede producirse siguiendo tres tipos de caminos diferentes, pudiendo ser:
- Electrofílica
- Nucleofílica
- De radicales libres
Reacción de sustitución electrofílica:
Este tipo de reacción sigue una serie de pasos:
-Primeramente se genera un electrofolito, produciéndose una reacción de equilibrio en presencia de un catalizador.
-El electrófilo ataca al núcleo aromático. Dichos proceso ocurre de manera lenta y es decisivo para la velocidad de la reacción.
- Se pierde el protón, el cual es cazado por un aceptor de protones, dando lugar a un producto de sustitución. Este paso se produce de manera rápida.
Las reacciones del benceno a partir de sustitución aromática son:
- Nitración del Benceno:
Reacción de monosustitución. En este caso, el ácido nítrico, sólo, o mezclado con ácido sulfúrico (mezcla sulfonítrica, formada por tres partes deacido sulfurico por una parte de ácido nítrico), da como resultado la obtención de productos derivados nitrados por sustitución. El sulfúrico coge el agua que se produce en la nitración, absorbiéndola pues tiene el papel de fuerte deshidratante, evitando la producción de una reacción inversa. La mezcla sulfonítrica reacciona con el benceno a una temperatura en torno a los 50-60ºC. A mayor temperatura se producirá una disustitución.
C6H6 + HONO2 ( H2SO4) → C6H5NO2 (nitrobenceno) + H2O
- Halogenación del Benceno:
Tanto el cloro como el bromo, producen derivados mediante sustitución de hidrógenos del benceno, dando lo que se conoce como haluros de arilo
Clorobenceno: C6H6 + Cl2 → C6H5Cl + HCl
Bromobenceno: C6H6 + Br2 → C6H5Br + HBr
Las reacciones de halogenación se ven favorecidas por temperaturas bajas, en presencia de un catalizador, como por ejemplo el hierro o algún ácido de Lewis, con el fin de poder polarizar el halógeno para producir la reacción. Al igual que la nitración, la halogenación también es una reacción de monosustitución.
- Sulfonación del Benceno:
Se produce cuando el benceno se trata con ácido sulfúrico (mezclado con SO3) para formar otros compuestos, tratándose de una reacción de tipo reversible.
C6H6 + HOSO3H (SO3) → C6H5SO3H (Ac.bencenosulfónico) + H2O
- Alquilación de Friedel – Crafts (síntesis):
El benceno se hace reaccionar con haluros de alquilo, en presencia de un catalizador (generalmente un ácido de Lewis como el cloruro de aluminio), formando compuestos homólogos. Es una reacción importante, pues permite incluir grupos alquilo en los anillos aromáticos.
C6H6 + CH3Cl → C6H5CH3 + HCl
- Alquilación del Benceno por alcoholes:
El tert- butilbenceno es el producto de una reacción entre el alcohol tert-butílico y el benceno (con el ácido sulfúrico presente).
- Alquilación del benceno con alquenos:
Si un alqueno entra en contacto con el benceno, en presencia de un catalizador de tipo ácido, se producirá una alquilación.
- Combustión:
El benceno es altamente inflamable, y produce una llama característica de todos los compuestos aromáticos, debido a la gran presencia del carbono en su estructura.
C6H6 + 15/2 O2 → 6CO2 + 3H2O
- Hidrogenación:
A través de catálisis, el núcleo del benceno, fija seis átomos de hidrógeno formándose así el ciclohexano manteniéndose la cadena cerrada.